Isolasi & Identifikasi Bakteri
Bakteriologi merupakan ilmu tentang bakteri, meliputi morfologi bakteri, klasifikasi bakteri, fisiologi bakteri. Khusus untuk bakteriologi klinis ruang lingkupnya hanya sekitar cara identifikasi bakteri terutama bakteri penyebab penyakit pada manusia, selain itu aplikasi bakteriologi klinik kini semakin luas meliputi bakteriologi air (pemeriksaan kualitas air) , bakterologi udara (pemeriksaan kualitas udara), bakteriologi makanan & minuman (pemeriksaan kualitas makanan dan minuman).
Identifikasi mikroba merupakan salah satu tugas yang lazim dilakukan di laboratorium mikrobiologi. Diagnostik laboratorium untuk suatu penyakit yang disebabkan bakteri harus dilakukan dengan cepat dan tepat sehingga pengobatan dapat dilakukan sedini mungkin.
Mikroba memiliki ukuran yang sangat kecil sehingga memerlukan alat pembesar yang disebut mikroskop dalam mengamatinya. Identifikasi bakteri didasarkan pada morfologi (bentuk, susunan, ukuran), karakteristik koloni (bau, warna koloni, sifat koloni terhadap media pertumbuhan, elevasi, bentuk pinggiran koloni) dan sifat biokimia (kemampuan bakteri yang berhubungan dengan fisiologinya), uji serologi. Kegiatan identifikasi dilakukan setelah kegiatan isolasi bakteri selesai, sehingga tehnik dalam melakukan isolasi perlu dikuasai oleh seorang petugas laboratorium klinik.
Mikroorganisme yang akan diisolasi dapat berupa biakan murni atau populasi campuran. Bila biakan yang akan diidentifikasi ini tercemar, perlu dilakukan pemurnian. Biasanya pemurnian dilakukan dengan cara menggores suspensi mikroba yang akan diisolasi pada lempengan agar sebagai media pertumbuhannya. Setelah diperoleh koloni terpisah, dibuat pewarnaan gram dari beberapa koloni untuk melihat kemurnian biakan. setelah diperoleh biakan murni, kegiatan dilanjutkan dengan melakukan serangkaian uji biokimia untuk memperoleh ciri biokimia dari bakteri uji. Setiap uji yang dilakukan harus menggunakan control untuk mengetahui apakah media serta reagens yang digunakan memenuhi persyaratan. Selain itu kontrol digunakan juga untuk melihat bahwa teknik yang digunakan benar dan tepat. Untuk mengetahui bahwa media yang digunakan bekerja dengan baik, dapat digunakan biakan mikroba yang memberikan hasil positif dan negatif. Uji yang digunakan dalam identifikasi bakteri tidaklah sama untuk setiap kelompok.
Berdasarkan penjelasan sebelumnya telah disebutkan bahwa salah satu hal penting dalam identifikasi bakteri adalah mengenal morfologi bakteri tersebut, teknik membuat sediaan untuk pemeriksaan mikroskopis serta mengetahui prinsip dasar beberapa teknik pewarnaan.
I. Morfologi Bakteri
Bakteri merupakan salah satu mikroorganisme yang dapat hidup di tempat yang tersebar di seluruh dunia. Morfologi bakteri diamati dengan menggunakan mikroskop. Untuk mengukur sel bakteri digunakan ukuran khusus yang disebut micrometer (1 mikron = 0,001 milimeter). Ukuran bakteri yang biasa diamati di laboratorium berukuran antara 0,15 sampai 1,5 µ lebar dan 1-5 µ panjang.
tempat yang tersebar di seluruh dunia. Morfologi bakteri diamati dengan menggunakan mikroskop. Untuk mengukur sel bakteri digunakan ukuran khusus yang disebut micrometer (1 mikron = 0,001 milimeter). Ukuran bakteri yang biasa diamati di laboratorium berukuran antara 0,15 sampai 1,5 µ lebar dan 1-5 µ panjang.
Bentuk dasar sel bakteri meliputi coccus (bulat), bacillus (batang), bentuk bengkok atau spiral (vibrio atau spirillium). Bakteri berkembang biak dengan cara membelah diri secara sederhana, setelah pembelahan sebagian bakteri berkumpul namun ada juga yang memisahkan diri dan membentuk rantai atau dua-dua.Berdasarkan hal itu maka dikenal adanya susunan/formasi bakteri yang berbeda-beda. Perbedaan susunan tersebut dapat dijadikan salah satu alat identifikasi genus atau spesies. Susunan bakteri yang umum ditemui adalah diplokokus (kokus berpasangan), streptokokus (formasi rantai), stafilococus (formasi bergelombol seperti buah anggur), tetrade (formasi kelompok berjumlah 4), Sarcina (formasi berkelompok berjumlah 8 menyerupai kubus).
Selain susunan bakteri, secara individu bakteri memiliki karakteristik yang berbeda, misalnya bentuk bakteri batang umumnya memiliki struktur tambahan yang disebut Flagela yang tidak dimiliki oleh bakteri bentuk kokus. Flagela terlihat seperti benang yang seluruhnya tersusun dari protein, berfungsi dalam pergerakan. Jenis bakteri tertentu mampu membentuk spora (endospora) untuk mengatasi perubahan lingkungan yang tidak menguntungkan bagi bakteri, dalam lingkungan yang menguntungkan spora bergerminasi kembali menjadi sel vegetatif. Spora bersifat tahan panas dan bahan kimia. Keberadaan spora ini dapat diamati melalui pewarnaan spora.
II. Teknik Membuat sediaan untuk pemeriksaan mikroskopik
Ada dua cara yang dapat dilakukan untuk memeriksa bakteri secara mikroskopis, yaitu : diperiksa secara langsung dan diwarnai dahulu kemudian diperiksa.
2.1 Pemeriksaan langsung
Pada pemeriksaan langsung , bakteri diperiksa dalam keadaan hidup. Kelebihan cara ini adalah cepat, mudah, dan murah namun harus diperiksa segera dan tidak dapat dibiarkan lama karena preparat akan cepat kering. Sediaan basah dilakukan dari bahan pemeriksaan langsung, menggunakan KOH untuk jamur dan NaCl untuk melihat bakteri dalam keadaan hidup. Cara ini juga dipakai untuk memeriksa gerak kuman secara mikroskopik. Ada dua cara pemeriksaan mikroskopik yang biasa dilakukan, yaitu :
1. Sediaan Basah
Caranya :
- ambil 1 ose biakan cair atau dari dari koloni yang disuspensikan pada larutan NaCl fisiologis, lalu oleskan di atas gelas objek
- tutuplah biakan tersebut dengan gelas penutup yang telah diolesi vaselin pada bagian tepinya
- segera periksa di bawah mikroskop dengan pembesaran 400x.
2. Tetes Gantung
Caranya :
- gunakan gelas objek cekung dan satu gelas penutup
- tiap ujung gelas penutup diberi vaselin
- lalu letakkan 1 ose suspensi bakteri ditengah-tengah gelas penutup
- gelas objek cekung ditutupkan (ditelungkupkan) di atas gelas penutup sehingga suspensi bakteri berada di antaranya
- sediaan ini kemudian dipasang pada meja mikroskop dengan gelas penutup berada di atasnya (dalam keadaan terbalik) sehingga posisi suspensi tergantung
III. Pewarnaan Bakteri
Bakteri hidup pada umumnya tidak berwarna dan tembus cahaya sehingga jika diperiksa secara langsung tidak dapat terlihat jelas. Tetapi dengan pewarnaan, sel bakteri akan diisi dengan zat warna sehingga menjadi berwarna dan tidak tembus cahaya, hal ini menyebabkan bakteri terlihat sangat jelas dan kontras dibanding dengan daerah sekitarnya.
Sediaan bakteri perlu dibuat dulu sebelum dilakukan pewarnaan. Terdapat 2 jenis sediaan bakteri yang dapat dibuat, yaitu sediaan oles dan sediaan hapus. Di bawah ini gambar kedua macam teknik pembuatan sediaan tersebut :
Caranya :
- ambil satu gelas objek yang bersih dan bebas lemak, lalu diberi tanda (bulatan) dengan spidol permanen pada bagian bawah gelas objek.
- letakkan satu ose suspensi biakan di bagian atas gelas tersebut
- suspensi dioleskan seluar garis tanda
- sediaan dikeringkan (diuapkan) di udara atau dihangatkan jauh di atas api
- lakukan fiksasi di atas api kecil tiga kali kemudian dilakukan pengecatan.
Macam-Macam Pewarnaan
Secara garis besar teknik pewarnaan bakteri dapat dikategorikan sebagai berikut :
1. pewarnaan sederhana
2. pewarnaan differensial : pewarnaan gram dan pewarnaan tahan asam
3. pewarnaan khusus untuk melihat struktur tertentu : pewarnaan flagel, pewarnaan spora, pewarnaan kapsul
4. pewarnaan khusus untuk melihat komponen lain dan bakteri : pewarnaan Neisser (granula volutin), pewarnaan yodium (granula glikogen)
5. pewarnaan negatif
3.1 Pewarnaan Sederhana
3.2 Zat warna yang dipakai hanya terdiri dari satu zat yang dilarutkan dalam bahan pelarut. Pewarnaan Sederhana merupakan satu cara yang cepat untuk melihat morfologi bakteri secara umum. Beberapa contoh zat warna yang banyak digunakan adalag biru metilen (30-60 detik), ungu kristal (10 detik) dan fukhsin-karbol (5 detik).
Caranya :
1. buat sediaan oles dan simpan di atas 2 batang kawat horisontal atau menggunakan bak pewarnaan.
2. beri zat warna sehingga seluruh sediaan tertutup penuh
3. biarkan selama waktuyang diperlukan, seperti di atas.
4. sediaan dicuci dengan air sampai bersih, lalu keringkan di antara dua kertas saring. Lalu dapat dilihat di bawah mikroskop dengan lensa objektif 100x menggunakan minyak imersi.
3.2 Pewarnaan Gram
Pada tahun 1883 Christian Gram seorang ahli mikrobiologi dari Denmark menemukan metode pewarnaan bakteri secara tidak sengaja. Pewarnaan gram merupakan pewarnaan diferensial yang sangat berguna dan paling banyak digunakan di laboratorium mikrobiologi. Pewarnaan ini merupakan tahap penting dalam pencirian dan identifikasi bakteri.
Zat warna yang digunakan lebih dari 1 zat warna, yaitu safranin, kristal violet ditambah 1 macam larutan pencuci yaitu alkohol serta 1 larutan mordan untuk meningkatkan afinitas pengikatan zat warna oleh bakteri.
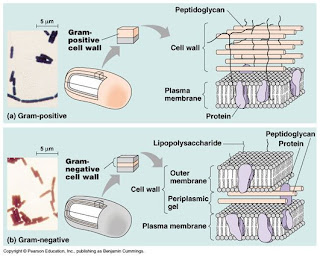
Pewarnaan gram memilah antara bakteri gram positif dan bakteri gram negatif. Bakteri gram positif berwarna ungu sedangkan bakteri gram negatif berwarna merah. Pewarnaan gram memberi hasil yang baik jika menggunakan biakan segar yang berumur 24-48 jam, karena pada biakan tua banyak sel yang mengalami kerusakan pada dinding selnya, hal ini mengakibatkan keluarnya zat warna ketika dicuci dengan larutan pemucat, sehingga menyamarkan hasil.
Caranya :
Prinsip : Pewarnaan gram didasarkan pada perbedaan struktur dinding sel bakteri, sehingga menyebabkan perbedaan reaksi dalam permeabilitas zat warna dan penambahan larutan pencuci. Dinding sel bakteri Gram positif terdiri dari lapisan peptidoglikan yang tebal sedangkan dinding sel bakteri Gram negatif mempunyai kandungan lipid yang tebal. Ketika ditambahkan pewarnaan kristal violet maka dinding sel bakteri Gram positif maupun Gram negatif akan menyerap zat warna tersebut namun ketika diberi alkohol, kristal violet pada Gram negatif akan luntur disebabkan struktur dinding selnya yang sebagian besar tersususun oleh lipid, sehingga ketika diberi safranin (zat warna kedua) dinding sel bakteri gram negarif akan menyerapnya kembali sehingga hasil pewarnaan bakteri Gram negatif akan berwarna merah, sedangkan bakteri gram positif akan tetap berwarna ungu walaupun diberi zat warna kedua, karena dinding selnya tersusun oleh lapisan peptidoglikan yang tebal sehingga tidak dapat dicuci oleh alkohol. Hal ini memberi hasil pewarnaan ungu pada bakteri Gram positif.
Caranya :
- buatlah sediaan oles bakteri
- tuang pada sediaan tersebut zat warna kristal violet, biarkan 1 menit
- zat warna dibuang lalu cuci dengan air mengalir
- beri larutan lugol, biarkan 1 menit
- lugol dibuang dan sediaan dicuci dengan air selanjutnya dicuci dengan alkohol 96% sampai tak ada lagi zat warna yang terlarut
- cuci dengan air sampai bersih
- tuangkan larutan safranin dan biarkan 1 menit, lalu cuci dengan air bersih
- keringkan dengan kertas saring
- periksa di bawah mikroskop dengan pembesaran 1000x )pakai minyak imersi)
3.3 Pewarnaan Tahan Asam
Pewarnaan ini ditujukan terhadap bakteri yang mengandung lemak dalam konsentrasi tinggi sehingga sukar menyerap zat warna, namun jika bakteri diberi zat warna khusus misalnya karbolfukhsin melalui proses pemanasan, maka akan menyerap zat warna dan akan tahan diikat tanpa mampu dilunturkan oleh peluntur yang kuat sekalipun seperti asam-alkohol. Karena itu bakteri ini disebut bakteri tahan asam (BTA).
Teknik pewarnaan ini dapat digunakan untuk mendiagnosa keberadaan bakteri penyebab tuberkulosis yaitu Mycobacterium tuberculosis . Ada beberapa cara pewarnaan tahan asam, namun yang paling banyak adalah cara menurut Ziehl-Neelsen.
Caranya :
- Buat sediaan oles bakteri
- tuangkan larutan karbolfuchsin sambil dipanaskan selama 5 menit dan perhatikan jangan sampai terlihat keluar uap
- biarkan dingin, lalu cuci dengan air mengalir
- sediaan dicelup dalam larutan asam alkohol yaitu larutan HCl 3 % dalam 95% etanol sampai tidak tampak lagi zat warna yang terlarut
- cuci dengan air.
- warnai dengan zat warna kedua biru metilen 1 % selama 1-2 menit
- cucilah sediaan dengan air
- keringkan di antara kertas saring
3.4 Pewarnaan Spora
Spora bakteri (endospora) tidak dapat diwarnai dengan pewarnaan biasa, diperlukan teknik pewarnaan khusus. Pewarnaan Klein adalah pewarnaan spora yang paling banyak digunakan. Hasil pewarnaan : badan bakteri berwarna biru, spora berwarna merah.
Caranya :
- Buat suspensi biakan bakteri berumur 72 jam dalam larutan NaCl Fisiologik di dalam tabung, tambahkan ke dalam suspensi tadi larutan karbol-fukhsin dalam jumlah yang sama banyak dan panaskan di atas api kecil selama 5 menit
- buatlah sediaan oles dari campuran tersebut
- setelah kering dan difiksasi tuangi larutan H2SO4 1 % selama 2 detik
- beri alkohol 96% selama 2 detik kemudian cuci dengan air bersih
- beri larutan biru-metilen dan biarkan selama 3 menit
- cuci lagi dengan air lalu keringkan dengan kertas saring

0 komentar:
Post a Comment